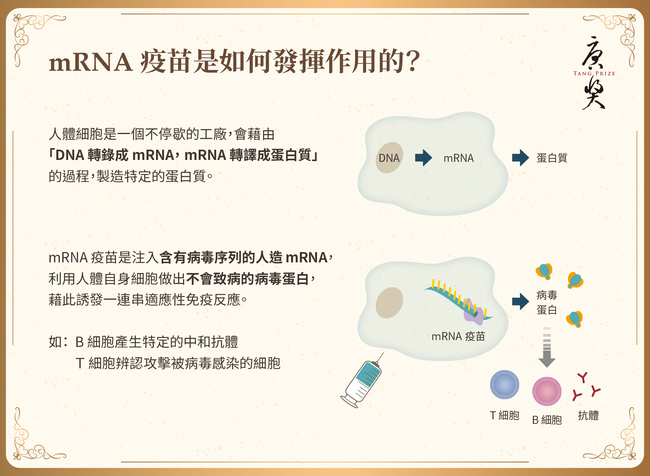
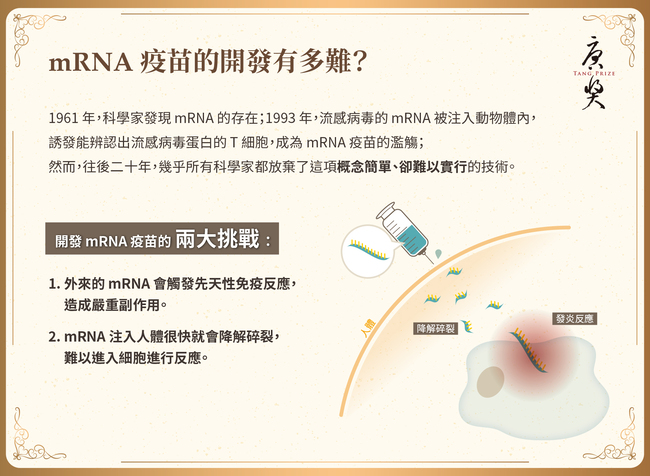
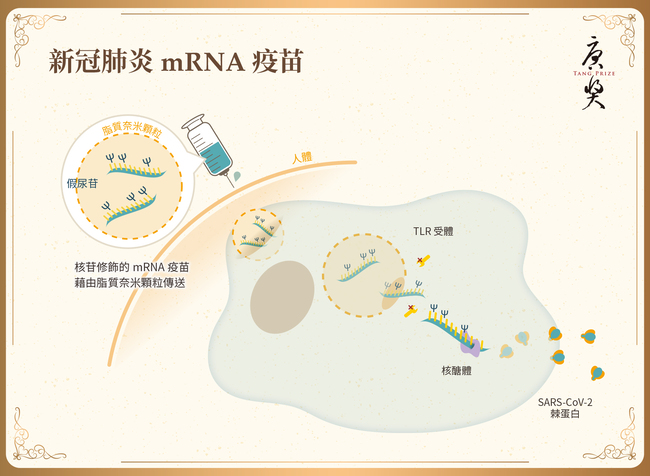
在生技醫藥的發展歷史上,人們從未如此深刻地體會到將卓越的基礎研究快速轉譯到臨床的影響。Pfizer/BioNTech和Moderna僅用不到12個月,就成功開發了新型冠狀病毒(SARS-CoV-2)的疫苗,而這些疫苗在全球各地已經挽救了數百萬人的生命。正如一位提名人提到:「近期沒有其他科學發現比能對抗新冠肺炎的mRNA疫苗對人類產生的影響更重大、更正面。」然而,這項快速的醫學進步來之不易,它是許多傑出且堅持不懈的科學家們付出艱鉅、甚至曾被低估的努力所得之結果。2022年唐獎生技醫藥獎授予他們中的三位:卡塔林·卡里科(Katalin Kariko)、德魯·魏斯曼(Drew Weissman)和彼得·庫利斯(Pieter Cullis),向他們致敬。他們開發的新平台使用經過核苷修飾的mRNA疫苗,並藉由脂質奈米顆粒在體內傳送。要將RNA送進人體有兩大挑戰,首先,RNA會觸發先天性免疫反應;其次,RNA在人體內極易降解,難以送達標的細胞或器官。三位獲獎者的突破性發現以及他們為克服這些問題開發的巧妙方法,是SARS-CoV-2疫苗能被快速開發的關鍵。這些技術不僅徹底改變了疫苗學,更開創了以RNA為療法的新時代。
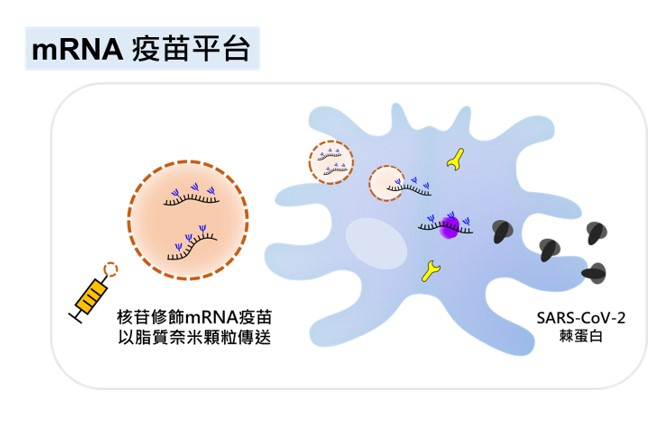
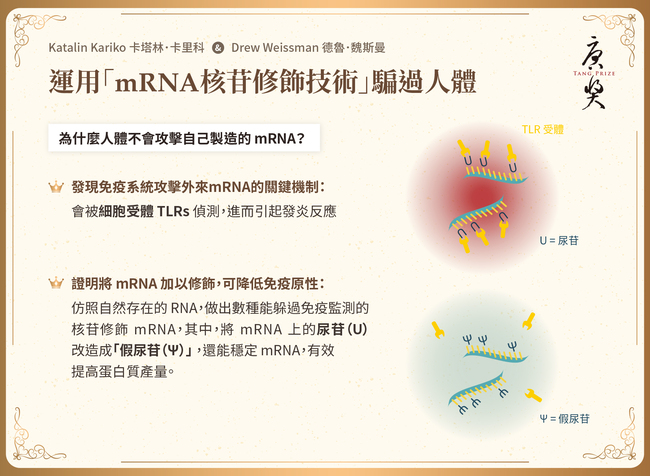
卡塔林·卡里科博士在匈牙利接受教育,並於1985年移居美國,追求她對於RNA疫苗和療法的興趣。更具體地說,她感興趣的是RNA及其化學合成,用以在體外/體內的細胞中有效地表達蛋白質。卡里科博士有系統且嚴謹地解決了將RNA使用在疫苗學和治療中的許多問題。在1990年代,作為賓夕法尼亞大學的研究副教授,她對開發用於蛋白質療法中的體外轉錄信使RNA(mRNA)產生了興趣。為此,她必須了解RNA媒介免疫反應的機制。她與她的同事德魯·魏斯曼博士一起證明了mRNA會被類鐸受體(TLRs)辨識,從而參與先天性免疫反應。若將mRNA注射到動物體內,會導致嚴重的發炎反應。然而,他們發現,如果mRNA的核苷經過修飾,就不會引發這些反應。他們因而推斷,被選定在自然存在的RNA(如tRNA)中的核苷通常會被甲基化或修飾,才能不被先天性免疫系統的受體所辨識。他們證明了TLRs確實不能辨識帶有修飾核苷的RNA,例如m5C、m6A、m5U、s2U或假尿密啶核苷。他們的關鍵發現創造了不會引起發炎的隱形 (stealth) RNA,發表在免疫學期刊中(Immunity. 2005;23(2):165-175)期刊中。他們還開發了重要的技術來純化足夠數量且不含寡核苷酸片段或雙股RNA的RNA製劑。她和魏斯曼博士創立了RNARx生技公司,並於2006年至2013年擔任執行長。從2013年開始,卡里科博士與BioNTech RNA Pharmaceuticals藥廠合作,首先擔任副總,後於2019年擔任資深副總,且持續擔任賓夕法尼亞大學的兼任教授。她作為BNT162-b2論文(Nature. 2021;595(7868):572-577)的共同作者,參與了BioNTech當前臨床獲准的新冠肺炎疫苗開發。卡里科博士和魏斯曼博士擁有非免疫原性、經核苷修飾的RNA應用之美國專利。他們為BioNTech開發/Pfizer生產和Moderna開發生產(US8278036B2 & US8748089B2)的新冠肺炎治療性疫苗奠定了基礎。顯然,她獨具開創性的研究對BioNTech和Moderna疫苗的開發都至關重要。
德魯·魏斯曼博士是賓夕法尼亞大學疫苗研究的羅伯茨家族教授,他於1997年在該大學開設了他的實驗室,研究開發HIV疫苗。在此之前,他曾在美國國家衛生院的安東尼·佛奇博士團隊中從事HIV相關研究(Nature. 1997;389(6654):981-985)。在與卡里科博士合作之後,他開始投入以RNA作為疫苗的研究。魏斯曼博士和卡里科博士最初合作的研究是關於能誘導發炎反應的樹突狀細胞之mRNA轉染(J Immunol. 2000;165(8):4710-4717; J Biol Chem 277:12689-96, 2002)。如前述,他們在2005年發表了至關重要的發現,在發現經過核苷修飾的RNA是非免疫原性的之後,魏斯曼博士一直積極投入於將該技術應用於開發針對HIV和Zika病毒等病毒感染之RNA疫苗(Nat Commun 8:14630, 2017; Nature 543:248-251, 2017)。由此可見,所有重要的發現都是團隊的努力,魏斯曼博士為這些計畫做出了重大貢獻,特別是提供了免疫學見解。
彼得·庫利斯是脂質奈米顆粒的開發先鋒,也是英屬哥倫比亞大學的教授,更是從分子層面研究膜結構和功能以開發有效治療藥劑的領導者。他的實驗室提出用於轉染的陽離子脂質可以在生物膜中誘導非雙層脂質的結構,從而解釋了轉染試劑如何促進以DNA和RNA為主的大分子在細胞內傳送。這對於開發RNA疫苗至關重要,因為RNA非常不穩定,且難以有效地傳送到細胞中。庫利斯博士的整個職業生涯都專注於從分子層面理解膜的結構和功能,並將這些知識用到治療目標上。他透過使用模型膜系統來研究脂質在膜中的作用,該系統促成了工程脂質體奈米顆粒(LN或LNP)系統,能傳送常規與核酸基底的藥物。他的研究興趣是在體內傳送siRNA到具有陽離子脂質的新顆粒中、或是傳送用於癌症和疫苗佐劑的免疫刺激藥物(如CpG)、以及包裹化學療法。他的經典論文每篇都被引用超過2000次,且大部分FDA獲准或用於緊急醫療用途的脂質奈米顆粒都依賴於他的技術。庫利斯博士的新技術使他成為11家公司的創辦人,其中,他與人共同創立了Acuitas公司,以開發脂質奈米顆粒藥物。2014年,他開始與魏斯曼博士合作,而當時其正在和BioNTech合作開發RNA疫苗,他們需要庫利斯博士在傳送系統方面的專業知識。2019年,Pfizer與他們一起努力生產含有LNP的mRNA流感疫苗,而當COVID-19大流行來襲時,Pfizer-BioNTech疫苗被製造了出來。很明顯地,若沒有庫利斯博士開發的傳送系統,對抗新冠肺炎的mRNA疫苗就不會如此成功地對人類健康帶來影響。
SARS-CoV-2 mRNA疫苗的成功開發必須使用:(一)用於逃脫免疫系統的核苷修飾RNA(由卡塔林·卡里科和德魯·魏斯曼博士提供)、(二)RNA編碼穩定的病毒棘蛋白(由巴尼·格雷姆和其茲梅其亞·科比特博士提供)和(三)質奈米顆粒技術 (由彼得·庫利斯博士提供)。 並且,BioNTech和Moderna的臨床團隊也應共享以創紀錄的速度開發疫苗的重要功勞。基於授獎人數的限制,在承認其他人的貢獻的同時,唐獎生技醫藥獎評選委員會選擇了卡里科博士、魏斯曼博士和庫利斯博士,作為最值得,和最有代表性的貢獻者。
出生日期: 1959年9月7日
出生地: 美國威斯康辛州米爾瓦基
國籍: 美國
專長領域:免疫學、疫苗學
Education
1987 美國波士頓大學免疫學/微生物學 醫學博士
1981 美國布蘭迪斯大學生物化學/酵素學 學士/ 碩士
Professional Experience
2021-Present 美國賓夕法尼亞大學醫學院疫苗研究羅伯茨家族教授
2017-Present 美國賓夕法尼亞大學傳染病組疫苗研究主任
2002-Present 美國賓夕法尼亞大學愛滋病研究中心免疫學核心實驗室聯合主任
2013-2021 美國賓夕法尼亞大學醫學院醫學教授
2007-2016 費城退伍軍人管理局醫療中心 (VAMC) 主治醫師
2006-2013 美國賓夕法尼亞大學醫學院醫學副教授
1997-2006 美國賓夕法尼亞大學醫學院醫學助理教授
1993-1997 美國國家衛生研究院國家過敏和傳染病研究所 (NIAID) 免疫調節實驗室高級研究員
1993 美國過敏和免疫學委員會成員
1990-1993 美國國家衛生研究院 (NIH) 過敏與免疫學研究員
1990 美國內科委員會成員
1987-1990 美國波士頓貝絲以色列醫院住院醫師
Awards & Recognition
2023 瑞典諾貝爾醫學獎
2022 日本獎
2022 美國富蘭克林研究所獎
2022 丹麥諾和諾德獎 (The Novo Nordisk Prize)
2021 美國拉斯克 (Lasker-DeBakey) 臨床醫學研究獎
2021 美國哥倫比亞大學路易莎·格羅斯·霍維茨獎 (The Louisa Gross Horwitz Prize)
2021 美國阿爾巴尼生物醫學獎 (The Albany Prize in Medicine)
2021 美國AJN獎 科學影響獎 (The Science Impact Award, AJN Awards)
2021 美國布蘭迪斯大學校友成就獎
2021 美國癌症研究所 科利基礎免疫學獎 (The Coley Award in Basic Immunology)
2021 美國布蘭迪斯大學 羅森斯蒂爾醫學傑出工作獎 (The Rosenstiel Award)
2021 美國杜克大學 CHAV-ID 傑出科學家
2021 研究!美國傑出研究倡議獎 (The Advocacy Awards, Research!America)
2021 國際業主教育基金會 (IPO Education Foundation) 年度發明家
2021 美國賓夕法尼亞大學高級和退休教師協會就職典禮 總統特聘演講者
2021 美國約翰斯科特獎 (The John Scott Award)
2021 西班牙阿斯圖里亞斯親王獎 (The Princess of Asturias Award)
2021 泰國瑪希敦王子獎 (The Prince Mahidol Award)
2021 美國波士頓大學醫學院 威爾金斯客座教授 (Wilkins Visiting Professor)
2021 美國賓夕法尼亞大學 Francis C. Wood 醫學研究獎
2019 美國醫師協會 (AAP) 成員
2018 美國杜克大學 Norman L. Letvin CHAVI-ID 學者獎
2018 美國賓州創新中心年度創新交易慶祝獎
2002 美國臨床研究聯合會成員
2001 美國免疫學家協會成員
1997 美國WW史密斯愛滋病研究獎 (The WW Smith AIDS Research Award)
1995 美國國立衛生研究院 (NIH) 特別成就獎
1995 美國國立衛生研究院 (NIH) 優異獎
1987 美國波士頓大學西德尼·庫珀班德獎
1987 美國波士頓大學亨利·巴克斯特獎學金
1987 美國波士頓大學內科獎
1985 美國波士頓大學研究生實習生獎
1983 美國癌症協會初級教師種子補助金
1983 Karin Grunebaum 癌症研究基金會研究員
1983 腫瘤生物學培訓補助金
Publications (Selected):
1. Weissman D, Rabin RL, Arthos J, Rubbert A, Dybul M, Swofford R, Venkatesan S, Farber JM, Fauci AS. Macrophage-tropic HIV and SIV envelope proteins induce a signal through the CCR5 chemokine receptor. Nature. 1997 Oct 30;389(6654):981-5
2. Weissman D, Ni H, Scales D, Dude A, Capodici J, McGibney K, Abdool A, Isaacs SN, Cannon G, Karikó K. HIV gag mRNA transfection of dendritic cells (DC) delivers encoded antigen to MHC class I and II molecules, causes DC maturation, and induces a potent human in vitro primary immune response. J Immunol. 2000 Oct 15;165(8):4710-7.
3. Karikó K, Buckstein M, Ni H, Weissman D. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity. 2005 Aug;23(2):165-75.
4. Pardi N, Secreto AJ, Shan X, Debonera F, Glover J, Yi Y, Muramatsu H, Ni H, Mui BL, Tam YK, Shaheen F, Collman RG, Karikó K, Danet-Desnoyers GA, Madden TD, Hope MJ, Weissman D. Administration of nucleoside-modified mRNA encoding broadly neutralizing antibody protects humanized mice from HIV-1 challenge. Nat Commun. 2017 Mar 2;8:14630.
5. Pardi N, Hogan MJ, Pelc RS, Muramatsu H, Andersen H, DeMaso CR, Dowd KA, Sutherland LL, Scearce RM, Parks R, Wagner W, Granados A, Greenhouse J, Walker M, Willis E, Yu JS, McGee CE, Sempowski GD, Mui BL, Tam YK, Huang YJ, Vanlandingham D, Holmes VM, Balachandran H, Sahu S, Lifton M, Higgs S, Hensley SE, Madden TD, Hope MJ, Karikó K, Santra S, Graham BS, Lewis MG, Pierson TC, Haynes BF, Weissman D. Zika virus protection by a single low-dose nucleoside-modified mRNA vaccination. Nature. 2017 Mar 9;543(7644):248-251.